燃料电池科普:质子交换膜、直接甲醇燃料电池、熔融碳酸盐燃料电池等工作原理
燃料电池是一种原电池或电化学电源,即通过转换化学反应的能量来产生电能的装置。其他种类的电化学电源是众所周知的家用一次性电池(手电筒、相机、电子和医疗设备等)和用于汽车、个人电脑、手机和许多其他设备的蓄电池。在这些电池中,化学反应用于发电,反应材料以及反应产物通常是金属或其他固体化合物(氧化物、盐等)。相比之下,在燃料电池中,反应物和产物通常是液体或气体。这允许向细胞连续供应反应物并连续去除反应产物。因此,燃料电池可以不间断地用于发电(锟放电锟),只要持续供应反应物并去除反应产物。与电池相比,它们在完全放电(反应物耗尽)后不需要更换或充电。
原电池的第一个原型是Volta桩,由意大利物理学家Alessandro Volta(1745-1827)于1800年建造。伏特桩对电力科学的发展非常重要。一种迄今为止未知的现象,即连续电流,现在可以实现。在Volta桩和其他不同电池出现后的几十年里,根据这些新电池提供的电流进行的实验,制定了电动力学和电磁学的基本定律。电化学电源的出现为电流的实际应用研究提供了动力。这些成就导致了电气工程理论和实践的快速发展,1870 年代出现了一种新的电源:电磁发电机(Werner von Siemens,1866 年),它很快在电气和经济方面都超过了他们的前辈。
随后,许多国家开始了火力发电厂的大规模开发。在这些工厂中,天然燃料(主要是煤)的燃烧能用于为驱动电磁发电机的热机提供动力。因此,在这些发电厂中,天然燃料的化学能分三个步骤转化为电能:首先在熔炉中通过燃烧(空气氧化)转化为热能,然后转化为机械能(在热机中),最后转化为电能(在发电机中)。
到这个时候,众所周知,热能(热)不是一种非常有用的能源。根据自然界的基本定律,热能转换为其他(有用)形式的能量(机械或电能)的效率存在最大(理论)值。这种最大效率取决于热机的工作温度。蒸汽机在350°C(662°F)的过热蒸汽下运行时,其最大效率为50%。一半的热能是不可挽回的损失。事实上,由于各种其他类型的热损失(传热、运动部件的摩擦等),实际效率甚至低于这个理论值。对于现代电厂来说,40%左右的总效率通常被认为是一个良好的性能。

燃料电池的概念最早是由德国物理化学家弗里德里希·威廉·奥斯特瓦尔德(Friedrich Wilhelm Ostwald,1853-1932,1909 诺贝尔化学奖获得者)。其主要思想是通过消除燃料燃烧的过渡阶段(热能的形成)来规避上述热机的局限性,并使用燃料化学能的单步转换为电能。他提议利用普通电池(天然燃料的燃烧锟)中发生的电化学机制,制造由空气中的氧气直接氧化天然燃料的装置。执行这种直接转换的设备被命名为 锟絝uel cell锟 。
奥斯特瓦尔德的论文是一篇开创性的基础论文,它标志着燃料电池领域大量研究的开始。奥斯特瓦尔德只考虑了燃料电池的理论能量转换方面,但他完全忽略了其他实际方面:涉及天然燃料的电化学反应是否可行,以及它们的效率如何。即使是在Ostwald锟絪论文发表后进行的第一次实验研究也表明,很难建造用于天然燃料直接电化学氧化的装置。
燃料电池的基本天然燃料包括各种碳氢化合物:天然气(甲烷)、高级碳氢化合物(丙烷、丁烷)、石油产品和化石碳,如煤。在首次尝试寻找这些燃料的有效直接电化学氧化方法失败后,很明显,在燃料电池中使用天然燃料的一种更现实的方法是首先通过化学(催化) 重整将它们转化为富含氢气的气体混合物。与其他类型的燃料相比,氢气很容易通过电化学机制氧化。因此,制造高效的氢氧(空气)燃料电池成为可能,燃料电池的大部分进一步发展(科学和工程研究)都朝着这个方向发展。
氢氧燃料电池布局示意图
单个燃料电池中的氢氧化和氧还原
当氢被氧气氧化时,形成水作为反应产物。在该反应中,氢原子被氧化,氧原子被还原。(有关详细信息,请参阅附录。如化学教科书所示,氧化反应是从反应粒子中提取电子;还原反应是将电子添加到反应粒子中。这意味着在氢氧化过程中,电子从氢中提取并转移到氧气中。当氢气在氢氧混合物中燃烧时,这些电子转移在反应粒子之间无序地发生在反应物占据的空间中,并且在任何特定方向上都无法观察到电子流动。
电化学运行该反应(在燃料电池中)的主要思想是组织这种电子流,并将其作为有用的电流引导到一个方向。

在最简单的情况下,燃料电池由两个浸入电解质溶液中的金属(例如铂 )电极组成(图 2)。反应气体氢气和氧气(通常以空气形式供应)被供应到各个电极。整个反应分为两个部分反应。在其中一个电极(称为阳极)上,氢分子被氧化,也就是说,它们将其电子转移到金属电极上,形成正氢离子(质子)。在另一个电极(称为阴极)处,氧分子被还原,即电子从金属电极转移到它们身上。这两个部分反应加在一起产生与整个反应相同的产物。(有关详细信息,请参阅附录。因此,在电化学反应方案中,整个反应发生在浸入电解质溶液中的两个不同电极上两个部分反应。在这个反应过程中,阳极获得电子并带负电,而阴极失去电子并带正电。为了避免阳极和阴极之间的意外接触(产生电池内部短路)并避免燃料和氧气的混合,通常在两个电极之间的间隙中放置绝缘多孔隔膜。
当两个电极通过某种电气设备(例如,灯)连接到电池外部时,电子从阳极(电池的负极)流向阴极(正极)。在电池内,在阳极形成的氢离子被转移(迁移)到阴极,在那里它们参与电极反应。溶液中的移动离子和金属中的电子共同产生闭合的电路。当通过外部设备闭合电路时,只要向电极供应反应气体,部分反应就会进行,并且外部电流会持续保持。因此,整个反应的一些化学能被转化为外部设备中使用的电能。化学能的剩余部分在实际用途中损失,并以热量的形式消散,因为需要额外的能量来迫使反应以有限的速率进行(参见过电压)。然而,这种损耗可能比传统(热-机械-电)能量转换系统中发生的损耗要小得多。
燃料电池堆和发电厂
单个燃料电池的电压(阳极和阴极之间的电位差)非常低,大约甚至小于一伏。大多数用户需要更高的电压,例如 6、12 或 24 伏或更高。因此,在燃料电池发电厂中,将适当数量的单体电池串联起来,形成燃料电池的电池堆(或电池,即电池的集合),即电池的正极连接到相邻电池的负极,以此类推,以达到所需的电压。一种常见的设计是由锟絙极电极锟构成的烟囱的压滤机设计。这种电极的一侧用作一个电池的阳极,另一侧用作相邻电池的阴极(图3)。

除了一个以上的此类电堆外,基于燃料电池的发电厂还包括一定数量的辅助设备和其他组件,以确保电堆稳定不间断地工作(图 4)。这些组件包括:
1.储存主要反应物(例如碳氢化合物、煤等天然燃料)的容器;
2.用于管理主要燃料(净化、 重整或气化)的设备;
3.热管理装置(去除反应热过剩或将烟囱加热到反应所需的温度);
4.用于去除反应产物的装置;
5.用于反应物供应的阀门、泵等;
6.不同的调节和控制装置;
7.功率调节设备(电表、转换器)。
附录中详细讨论了许多描述燃料电池和燃料电池发电厂的非常重要的特征性技术参数。
低温燃料电池
第一批原型
在1830年代,英国化学家威廉·格罗夫爵士(1811-1896)进行了一系列关于水电解的实验。他的装置由两个铂电极组成,浸入用硫酸酸化的水中。断开电流后,氢气和氧气早先作为气体逸出的电极被极化,也就是说,它们之间保持一定的电位差。当在这种状态下它们通过外部电路连接时,发现电流在该电路中流动。格罗夫称他的发明为锟絭酸电池锟。他的研究结果于1839年发表在《哲学杂志》上。这个日期在历史上被认为是燃料电池的开始,尽管格罗夫本人并不认为他的电池是产生电能的实用手段。(编者注。Schoenbein也在同一时间(甚至更早)进行了类似的实验。
1889年,蒙德和兰格在使用氢氧电池产生电流方面进行了相对成功的实验。当时,他们的结果在电化学文献中被广泛讨论。但是,正如Wand在他的锟紽uel Cell History锟(2006)中所写的那样:当时没有人知道如何处理像这种燃料电池这样的发明。一个多世纪以来,没有发现任何实际或商业应用。在那个时代完全没用。
碱性燃料电池 (AFC)

1932年,英国剑桥大学工程学教授弗朗西斯·托马斯·培根(Francis Thomas Bacon,1904-1992)开始着手修改早期的蒙德和兰格电池。培根没有使用高腐蚀性的酸性溶液,而是使用碱性(氢氧化钾)电解质。他使用了由镍粉制成的多孔气体扩散电极。第一个碱性燃料电池培根电池于1959年获得专利。1960 年,他公开演示了功率为 5-6 kW 的燃料电池堆。为了加速电化学过程,培根使用了高工作温度(超过200°C,392°F)和高气压(高达40个大气压),从而产生了非常庞大和沉重的烟囱设计。培根燃料电池的示范引起了科学技术界的高度重视,在许多国家开始了该领域的大规模研发工作(第一次电池热潮)。

在 1960 年代初期,飞机发动机制造商普惠公司获得了使用培根燃料电池的许可。该公司的工程师对烟囱设计进行了重大更改,以简化它,降低气体压力、工作温度和发电厂的重量。这些P&W燃料电池在1960年代后期被用于阿波罗计划,即太空飞行到月球。在P&W与United Technology Corporation(UTC Power)合并后,开发了一种新版本的这种碱性燃料电池(图6),其效率大大提高。从 1970 年代中期至今,美国宇航局一直在航天飞机中使用该电池。在这些燃料电池中,使用纯氧代替空气,这也避免了空气中的二氧化碳对碱性电解质的污染。
在燃料电池中使用碱性电解质的一个相当大的优点是可以避免使用非常昂贵的铂催化剂,这些催化剂必须用于下面描述的酸性 电解质的燃料电池版本。早在1962年,德国物理学家爱德华·贾斯蒂(Eduard Justi)和他的同事就已经证明,多孔镍和银可以用作低温碱性燃料电池电极的催化剂。在 1960 年代,在联合碳化物公司工作的奥地利电池专家 Karl Kordesch 开发了一种碱性燃料电池堆,该电池堆以多层碳电极和氧化钴为催化剂。后来,他将这种燃料电池装进了自己的汽车中,成为俄亥俄州帕尔马市第一个经常在城市道路上使用带有燃料电池的电动汽车的人(图 7)。

磷酸燃料电池(PAFC)
在酸性溶液中,唯一实用的催化剂是铂(或铂族的其他金属),用于增强氢电极和氧电极上的电化学反应。在燃料电池的第一个原型(Grove、Mond 和 Langer 等)中,硫酸 水溶液被用作电解质。这些原型的效率非常低。在接下来的一段时间里,人们进行了许多尝试来提高这种效率,但硫酸不能很好地用作燃料电池电解质。这是因为硫酸的阴离子很容易吸附在铂催化剂的表面,导致催化活性大大降低。
在 1960 年代初期,人们发现磷酸的浓缩溶液可以产生更好的结果。与硫酸相比,磷酸的阴离子不吸附在铂上。此外,由于浓磷酸的沸点高,燃料电池的工作温度可以提高到200°C(392°F)以上;在这些温度下,电化学反应的速率远高于以前使用的低于100°C(212°F)的温度。
使用这种浓缩(95%或更多)磷酸溶液导致了高效氢氧(空气)燃料电池的发展。在这些细胞中,液态酸包含在厚度约为 50nm 的多孔基质的细孔中。当基质被酸淹没时,它的行为类似于固体电解质,也就是说,它表现出离子电导率(对于氢离子),但它不受反应气体的渗透。因此,该基质既可作为电解质,又可作为防止气体混合的分离器。
铂催化剂以高度分散(非常小)颗粒的形式沉积在电子导电 碳质载体上。这使得增加催化剂的总表面积(反应区)成为可能,而不会过多地增加昂贵的铂金属的量。
在 1975 年至 1985 年的十年间,PAFC 领域的研究非常普遍,许多学术和工业机构逐渐加入了这一努力。1969 年,UTC Power 建造了一座大型工厂,用于大规模生产 200kW 基于 PAFC 的动力装置。这些装置使用天然气运行,包括将天然气转化为氢气和氢气净化的设备。它们设计用于住宅和市政结构(如医院等)的现场热力和电力组合。1983年,UTC电力公司与日本公司一起在日本开发并建造了一座4.8兆瓦的发电厂。该 PAFC 工厂使用大型电极,尺寸为 0.34 m2。该工厂在 1983 年至 1985 年间运营,共产生 5400 MWh 的电能。
1995年后,科学文献中关于磷酸燃料电池的论文很少。当然,早期建造的许多不同的发电厂仍在运行,但进一步开发和改进的工作实际上已经停止。尽管PAFC燃料电池受到关注的时间很短,但它们在燃料电池的发展中发挥了重要作用。燃料电池电站的大规模工业化生产首次开始。全世界许多科学界和商界已经认识到,燃料电池在对人类有用的应用中具有真正的潜力。
质子交换膜燃料电池(PEMFC)
1950 年代末,通用电气的Thomas Grubb 和 Leonard Niedrach 开发了 PEM 燃料电池,这是一种使用质子传导固体离子交换膜作为电解质的氢氧燃料电池。这种燃料电池版本已商业化,并在 1960 年代初期用于双子座航天器的发电。这是一个历史性事件,是燃料电池作为电源的首次实际应用。这一应用的成功促进了不同种类燃料电池的进一步发展。当双子座飞行结束时,这种燃料电池的工作几乎结束了,在随后的太空飞行中,美国宇航局依靠更高效的碱性燃料电池(见上文)。直到1980年代后期,锟絧子交换膜燃料电池(也称为锟絧olymer-电解质-膜燃料电池)的工作才再次开始。

在经历了近三十年的休眠期之后,在1990年代初期,PEMFC取得了显著的改进。 比功率几乎增加了一个数量级,可以减少昂贵的铂催化剂的数量,并且可以大大延长这些燃料电池的寿命。基于这些成就,Costamgna和Srinivasan在2001年将他们的全面回顾命名为:从1960年代到2000年,PEMFC科学技术的跳跃。这一进展是由两个因素共同作用的:(i)开发和引入了一种称为Nafion®的新型质子传导离子交换膜;(ii)开发新的电极制备方法,使电极中铂催化剂的利用效率大幅提高,正如Gottesfeld和Zawodzinski在1997年所描述的那样。
质子交换膜燃料电池(以及一些其他类型的燃料电池)的核心是膜电极组件(MEA),由夹在两个(氢和氧)电极之间的离子交换膜组成。每个电极又由一个催化层组成,该催化层包含沉积在碳质载体(主要是炭黑和石墨化布)上的分散铂催化剂,以及一个薄的多孔气体扩散层,该层能够将反应气体均匀地供应到催化剂表面位置。
单个PEMFC电池的结构示意图如图8所示。每个电池通过电子导电双极板与相邻电池隔开。该板的一侧与给定电池的正极接触,另一侧与相邻电池的负极接触。板的两侧都包含通道,将反应气体供应到放置在两个双极板之间的多层 MEA。
在 PEMFC堆栈中,所需数量的电池被夹在两个端板之间,端板也用作消耗电流的端子。除了带有双极板的单个电池外,燃料电池堆中还包括特殊的热交换板,用于去除运行过程中产生的热量。
质子交换膜燃料电池的工作温度约为80°C(176°F)。单节电池的工作电压在0.6至0.85 V之间变化,具体取决于消耗的电流。
截至目前(2009年),质子交换膜燃料电池堆和电厂已达到高度完善。它们工作可靠,表现出相当好的电气特性,并且操作方便。目前,它们由不同国家的许多公司以商业规模生产。质子交换膜燃料电池发电厂已在许多领域得到实际应用,例如具有重要战略意义的设施(例如,医院、指挥站、自来水厂、天然气供应商、电信中心)的备用电源。它们还被发现用于个人住宅和办公楼的电力和热力组合供应。许多地方都利用这种发电厂的定期巴士服务(图9)。

直接甲醇燃料电池(DMFC)
氢气是一种非常活跃的还原剂(燃料)。因此,在氢氧燃料电池中,可以实现非常高的工作电流和每单位重量的高比功率值。然而,氢燃料的处理、储存和运输非常复杂。这主要是针对相对较小的便携式发电厂的问题。对于这样的工厂,液体燃料更现实。
甲醇是一种非常有前途的小型便携式燃料电池燃料。它比气态氢更方便,危险性更小。与石油产品和其他有机燃料相比,甲醇具有相当高的电化学氧化活性(尽管不如氢气高)。其化学能比含量约为6 kWh/kg,虽然低于汽油(10 kWh/kg),但相当令人满意。出于这个原因,它在电动汽车和不同便携式设备的发电厂燃料电池中的应用今天被广泛讨论。直接甲醇燃料电池中发生的电化学反应见附录。
从1960年代初开始,这种反应的机制是不同国家许多研究的主题。同时,对建立甲醇-氧气(空气)燃料电池的测试模型进行了多次尝试。由于甲醇对铂的氧化速率相对较低,因此在这些模型中必须使用大量的铂催化剂。尽管如此,获得的比功率还是很小的。出于这个原因,人们的兴趣逐渐消退,很长一段时间以来,人们认为,对于实际应用,甲醇只有在初步转化为氢气后才能用作燃料电池的燃料。
直到 1990 年代中期,在开发具有质子传导 离子交换膜的氢氧燃料电池取得巨大成功之后,甲醇直接(无初步转化)氧化燃料电池的开发才取得突破。这种类型的燃料电池现在被称为锟絛直立甲醇燃料电池(DMFC)。现代DMFC的设计与质子交换膜燃料电池的设计非常相似。两种燃料电池都使用相同的膜(Nafion®)和类似的催化剂。它们之间的主要区别在于燃料的性质。甲醇可以通过两种方式供应:初步蒸发后呈气态,或以液态形式作为甲醇水溶液供应。后者导致电池设计更加简单,因为不需要特殊的蒸发器。它还具有与燃料一起提供足够量的水以保持膜的高离子电导率的优点。
DMFC的运行存在质子交换膜燃料电池所不存在的基本问题。在后者中,膜实际上不受反应物(氢气和氧气)的渗透,从而防止它们混合。相反,在DMFC中,膜被溶解在水溶液中的甲醇部分渗透。出于这个原因,一些甲醇从电池的阳极部分穿过膜渗透到阴极部分。这种现象称为锟絤乙醇交叉锟。这种甲醇在铂催化剂上被气态氧直接氧化,而不产生有用的电子。这会产生两个后果:(i)在电化学反应中损失了很大一部分甲醇,(ii)氧电极的电位转移到较低的正值,因此燃料电池的工作电压降低。尽管到目前为止进行了许多调查,但仍无法完全解决这个问题。
DMFC 的一个潜在应用领域是用于电子设备的低功耗(高达 20W)电源,例如笔记本电脑、摄像机、DVD 播放器、手机、医疗设备等。目前,DMFC作为电动汽车电源的应用非常遥远。尽管进行了大量的研究,但与质子交换膜燃料电池相比,DMFC仍未投入商业生产或广泛实际使用。
高温燃料电池
在上述所有燃料电池类型中,水溶液都用作电解质。此外,在具有离子交换膜的燃料电池中,需要一定量的液态水才能保持膜足够的离子电导率。因此,这些燃料电池的工作温度被限制在远低于水沸点的温度。还有其他类型的燃料电池在高于300°C(572°F)的温度下工作,使用不需要水的电解质和膜来导电。这些高温燃料电池具有许多优点。
·无需使用昂贵的铂金属催化剂。 电化学反应的速率随温度的增加而增加,它们在催化活性较低的金属(例如镍)上的速率对于实际目的来说是相当令人满意的。
·
·没有必要使用高度纯化的反应物。在低温燃料电池中,即使是少量的某些杂质(如氢气中的一氧化碳)也会通过吸附在表面使铂催化剂失活,导致运行效率大幅降低。在较高的温度下,实际上没有观察到这种现象。
·
·可以使用氢气以外的燃料。高温燃料电池的主要优点之一是可以使用一氧化碳作为燃料。一氧化碳很容易通过煤的蒸汽气化获得,即一氧化碳和氢气的混合物。这为间接电化学利用巨大的煤炭储量提供了可能性。
·
·可以直接将天然燃料的重整与燃料电池集成在一起。尽管温度较高,但石油产品或天然气(甲烷)等天然燃料的直接电化学氧化速率仍然可以忽略不计。因此,只有在转化为氢气后才能使用天然燃料。天然燃料的催化转化(重整)需要大量的热量。因此,将重整与燃料电池直接耦合是合理的。在这种情况下,高温燃料电池在运行过程中在高温下释放的热量可用于重整反应,从而提高燃料利用的整体效率。这种包含高温燃料电池和重整的组合单元通常称为内部重整燃料电池(IRFC)。
熔融碳酸盐燃料电池 (MCFC)
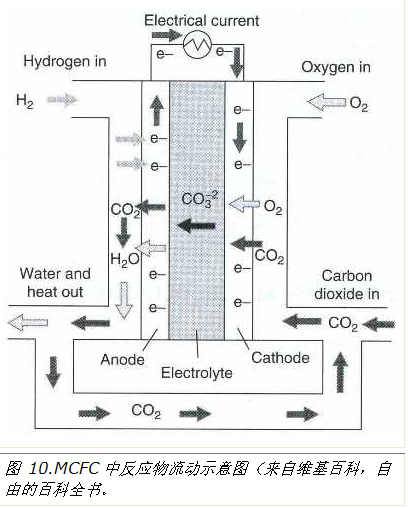
经过漫长的休眠期后,1960年代在许多地方恢复了熔融碳酸盐燃料电池的工作。Broers和Katelaar在阿姆斯特丹(1961年)做出了这一领域的重大贡献。这些电池中的电解质是不同碱金属碳酸盐混合物的熔体。MCFC的工作温度约为600-650°C(1112-1202°F)。液体熔体固定在由烧结镁或锂/氧化铝粉末制成的多孔陶瓷基体的细孔中。如上所述,对于质子交换膜燃料电池,充满液体熔体的多孔基质表现得像固体电解质,并且不被反应气体渗透,从而防止它们的混合和直接相互作用。这些电池中的电极基于多孔镍。用于燃料氧化的阳极由镍和2-10%铬的合金制备。用于氧还原的阴极由掺杂(处理)氢氧化锂的氧化镍制成。这种氧化镍的锟絣ithiization锟增强了其导电性和 耐腐蚀性。
在碳酸盐熔体中,形成金属和碳酸盐离子并提供电解质的导电性。由于这些熔体中不存在水或氢离子,因此电化学反应与低温燃料电池中发生的电化学反应有很大不同(详见附录)。在MCFC中,反应包括碳酸根离子和二氧化碳。与大多数其他版本的燃料电池不同,MCFC的一个特点是,阴极反应不仅消耗氧气,还消耗二氧化碳,同时在阳极反应中产生二氧化碳。因此,在MCFC运行期间,有必要将阳极释放的二氧化碳返回阴极(图10)。
大约在 1960 年代中期,许多国家(美国、德国、日本等)的工业组织对 MCFC 产生了兴趣,并开始开发和生产基于这些电池的发电厂。到 2000 年,建造和安装了 40 多座发电厂,规模从 250kW 到 1 MW 不等。最大的MCFC发电厂于1994/1995年在加利福尼亚州圣克拉拉建成,功率为2兆瓦。由于一些技术问题,该工厂的运营于1996年终止。该工厂运行了约6000小时,产生了2500 MWh的电能。
固体氧化物燃料电池(SOFC)
固体氧化物燃料电池的构造是可能的,因为一些金属氧化物化合物由于氧离子在电场中的迁移而在高温下表现出相当大的导电性。这种化合物最著名的例子是掺杂了约10%氧化钇的二氧化锆(锟統锆稳定氧化锟,YSZ)。该化合物于1897年由德国物理化学家Walther Nernst(1920 诺贝尔化学奖获得者)在他的辉光灯中,它被称为锟絅ernst mass锟。然而,YSZ的离子电导率只有在高于900°C(1652°F)的温度下才能被接受。
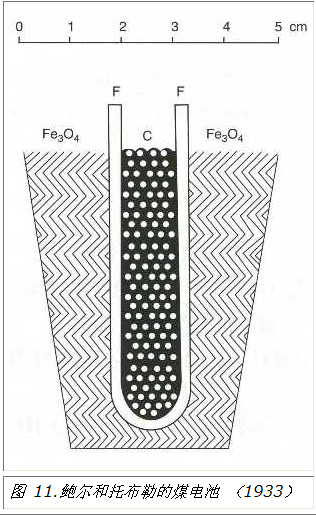
早在 1930 年代,瑞士科学家埃米尔·鲍尔 (Emil Baur) 也从事熔融碳酸盐燃料电池的研究,他试图将这种能斯特质量用于在 1000oC (1832oF) 的温度下以碳为燃料的燃料电池(图 11)。这种锟絚细胞锟的寿命很短。为了增加这种固体电解质的寿命和电导率,在莫斯科工作的亚美尼亚科学家Oganes Davtyan在1940年代对稀土元素的不同氧化物的混合物进行了大量研究。
1962年,在燃料电池开发新时期的开始,西屋电气公司的Weissbart和Ruka开发了一种具有管状YSZ型电解质的燃料电池。从那时起,这种管状设计被广泛用于SOFC。1968年,西屋公司与德国西门子公司共同成立了一家合资企业西门子-西屋公司,专门从事管状SOFC的进一步开发和商业化。该企业很快成为该领域的世界领导者。
在现代管状 SW 电池中,陶瓷管是通过挤压阴极材料(镧锰酸盐并添加一些碱土金属氧化物)生产的。在管子的外部,通过电解质锟絪成分的气相沉积施加一层薄薄的YSZ 电解质。在电解质的顶部,阳极材料(镍和氧化镍粉末)从浆料中涂覆。这种管状SOFC的工作温度约为900°C(1652°F)。由于电解液中的导电离子是氧离子,因此氢氧SOFC中的电化学反应与低温或熔融碳酸盐燃料电池中的电化学反应不同(详见附录)。
燃料电池领域的新工作方向
质子交换膜燃料电池的成功开发导致了燃料电池领域新工作方向的出现。除了努力建设强大的工厂以提高电网发电效率外,还追求第二种应用,即建造中小容量的自主电源。这种电源适用于电网能源无法获得的应用,例如运输、便携式设备和偏远地区。“电池电池”一词开始失去其作为由天然燃料驱动的电化学电源的原始含义,并获得了与普通电池相比,只要提供反应物即可连续工作的电化学电源的含义。这种类型的第一个应用是在阿波罗号和双子座号航天器上。目前,许多国家正在这些领域开展大规模工作。
用于电网供电的大型燃料电池发电厂
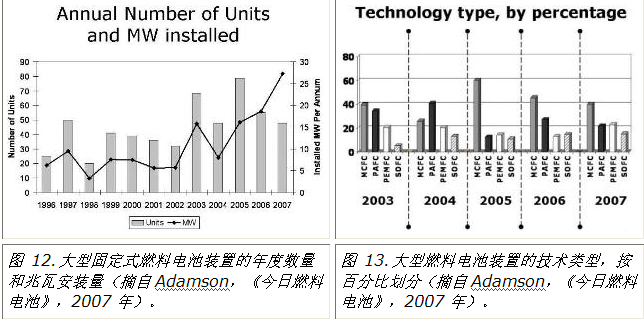
已经提到,使用质子交换膜燃料电池,UTC-Power公司生产了大量固定式(200-kW)发电厂,用于住宅和社区建筑的分散式能源和供热。许多国家都建造了使用不同类型燃料电池的大型多兆瓦发电厂。图 12 显示了 1996 年至 2007 年间每年建造的此类电厂数量,以及每年增加的电力(以兆瓦/年为单位)。图13显示了每年用于建造这些工厂的各种燃料电池系统的百分比。
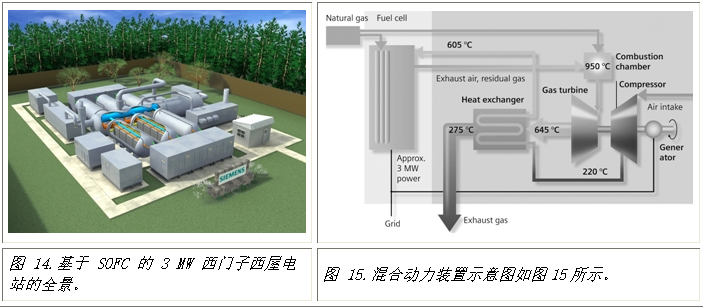
近年来,人们一直在努力建设混合动力工厂,将高温燃料电池和燃气轮机相结合。这种混合电厂的基本思想是高效协调进出这种联合电厂的两个组成部分的气流和热流。这种安排将减少能量损失并提高整体效率。图 14 显示了计划于 1912 年投产的基于 3MW 固体氧化物燃料电池的西门子-西屋混合动力发电厂的整体视图和示意图。由于燃气轮机中残余氢气的燃烧以及其他改进,预计其整体效率将达到 70%。
用于便携式设备的小型燃料电池工厂
过去,不同类型的蓄电池或一次性电池被用作便携式电气和电子设备的电源,例如手电筒和便携式无线电接收器。在 1990 年代,开始大规模生产许多用于家用、医疗和军事用途的新型电子设备(笔记本电脑、摄像机、手机、视频播放器、个人通信设备等)。便携式设备需要非常低的功率才能运行,不超过 5-10 W,通常甚至在毫瓦范围内。然而, 电池只能维持这些设备的不间断运行几个小时。电池放电和耗尽后需要更换或充电是这些新设备的严重缺点。对具有更长不间断工作时间的新电源的需求变得非常迫切。这导致了大量研究和开发工作,以开发小型、低功率的燃料电池工厂(所谓的微型燃料电池)。将这些微型燃料电池引入国内应用可以为燃料电池的广泛商业化开辟道路。
电动汽车燃料电池工厂
大城市中不断增加的车辆交通量正在造成温室气体(二氧化碳)和许多有毒物质(如一氧化碳、氮氧化物和含硫化合物)的严重空气污染。这种空气污染导致的健康问题导致许多国家(特别是美国的加利福尼亚州)强制要求汽车制造商生产和销售一定数量的低排放甚至锟絲排放的车辆。因此,汽车制造商被迫想方设法用其他动力装置取代内燃机。其中一种可能性是开发电动汽车。由电池供电的电动汽车在生产工厂内的运输和某些送货上门(如奶制品和邮件)中的使用相对较大。电池供电的汽车在电池充电站之间的行驶里程非常有限,不到 80-100 英里。电池耗尽后,需要很长时间才能充电(锟絩efueled锟)。这些缺陷阻止了大规模引入电池动力汽车作为内燃机汽车替代品的可能性。使用中型燃料电池发电厂(50-100 kW)作为电动汽车的动力源将解决续航里程和加油时间的问题。出于这个原因,几乎所有的大型汽车制造商现在都开始探索生产高效便捷的燃料电池汽车的可能性。很快,人们就发现这项任务涉及一些基本问题。其中一个问题是难以在小型车辆上储存装有压缩气态氢的笨重罐。出于这个原因,内燃机很可能会首先在大型车辆(卡车和公共汽车)中被燃料电池工厂取代,这些车辆是造成大城市空气污染很大一部分的原因。另外两个问题(燃料电池工厂的成本及其寿命)将在下一节中讨论。
燃料电池领域存在的主要问题
如上所述,所有主要的燃料电池系统都已经离开了实验研发阶段,并成为经济现实。已经建造了许多基于这些系统的大型发电厂。它们已经证明每单位发电的天然燃料消耗量更低,温室气体和其他有害产品的排放也更低。这些发展在很大程度上是由政府计划发起和/或资助的工作的结果。目前,基于电动汽车质子交换膜和直接甲醇燃料电池的中型发电厂的开发工作也部分由不同的政府计划赞助。
相比之下,政府机构没有参与开发小型燃料电池发电厂,这些发电厂主要基于质子交换膜和直接甲醇燃料电池的便携式设备。这一领域的发展主要是由市场驱动的(封闭的军事部门除外)。因此,此类植物的商业化生产和民用应用仍在缓慢进行中。
要确保燃料电池发电厂在潜在的数百万美元电动汽车和新型便携式电子设备市场中得到更广泛的使用,有两个问题需要解决。
经济问题
目前,与其他类型的发电厂相比,燃料电池发电厂的制造成本非常高。这不仅是由于劳动力成本高(随着产量的增加可以显着降低),而且还由于材料成本高。所有质子交换膜和直接甲醇燃料电池(Nafion®膜)中最重要的组件之一非常昂贵,约为700 $ / m2。尽管这些燃料电池电极上使用的铂量急剧减少,但铂催化剂的价格仍然相当可观。根据Kamarudin(2006)的一篇论文,5千瓦质子交换膜燃料电池发电厂的总成本约为1200美元/千瓦;实际燃料电池堆(膜:55 $/kW,铂金:52 $/kW)为 500 美元/kW,辅助设备(泵、热交换器等)为 700 美元/kW。相比之下,类似内燃机的成本为 500-1500 美元/千瓦。
进一步降低制造成本是未来燃料电池动力电动汽车可能大规模生产和商业化的先决条件。
寿命问题
对于燃料电池工厂的任何实际应用,它们必须显示出令人满意的使用寿命,在此期间可以在给定模式下平稳运行。对于便携式设备中使用的小型植物,使用寿命必须约为三年。对于电动汽车,它必须大约五年,对于大型固定式多兆瓦发电厂,它必须长达十年。单个质子交换膜燃料电池和燃料电池堆的样品已成功运行数千小时。这些结果可以被认为是非常有希望的,因为它们表明,从根本上说,质子交换膜燃料电池可以运行数年。然而,对于这种类型的燃料电池的一般用途,没有足够的数据。出于这个原因,目前正在进行大规模的研究工作,重点是寻找效率逐渐下降和单个燃料电池过早失效的原因。
附录
酸性电解质中的氢氧燃料电池反应
[1] |
H 2 + 1/2O 2 ==> H2 O |
(整体反应) |
[2] |
H2 ==> 2H+ + 2e- |
(氧化反应) |
[3] |
1/2O 2 + 2H+ + 2e- ==> H2 O |
(还原反应) |
直接甲醇燃料电池反应
[4] |
CH3OH + 3/2O 2 ==> CO 2+2H 2 O |
(整体反应) |
[5] |
CH3OH + H 2 O ==> CO2 + 6H+ + 6e- |
(氧化反应) |
[6] |
3/2O 2 + 6H+ + 6e- ==> 3H2 O |
(还原反应) |
熔融碳酸盐燃料电池反应
使用氢气作为燃料:
[7] |
H 2 + 1/2O 2 ==> H2 O |
(整体反应) |
[8] |
H 2 + 一氧化碳3 2- ==> H 2 O + 一氧化碳 2+ 2e- |
(氧化反应) |
[9] |
1/2O 2 + 一氧化碳 2 + 2e- ==> 一氧化碳3 2- |
(还原反应) |
使用一氧化碳作为燃料:
[10] |
一氧化碳 + 1/2O 2 ==> 一氧化碳2 |
(整体反应) |
[11] |
一氧化碳+ 一氧化碳 3 2- ==> 2一氧化碳2 + 2e- |
(氧化反应) |
[12] |
1/2O 2 + 一氧化碳 2 + 2e- ==> 一氧化碳3 2- |
(还原反应) |
固体氧化物燃料电池反应
[13] |
H 2 + 1/2O 2 ==> H2 O |
(整体反应) |
[14] |
H 2 + O 2- ==> H2 O+ 2e- |
(氧化反应) |
[15] |
1/2O 2 + 2e- ==> O2- |
(还原反应) |
燃料电池技术参数
燃料电池非常重要的参数是在给定条件下(在给定工作电流下)观察到的开路电压锟経o锟和工作电压锟経i锟。工作电池的电压越低,电流越高。有时这种关系用一个简化的方程来表示:
[注16]Ui = Uo + IR应用程序
其中表观内阻锟絉app锟有条件地视为一个常数。
燃料电池在任何给定电压下的工作电流 锟経i锟 在外部负载上,电阻为锟絉ext锟,由欧姆锟絪定律给出:
[注17]I = Ui / R分机
由于锟経i锟反过来取决于电流,通过组合最后两个方程,电流的表达式变为:
[注18]I = Uo / (R应用程序 + R分机)
在燃料电池运行期间,输送的功率为 锟絇 = Ui × I锟 ,或使用上述公式:
[注19]P = Ui 2 R 应用 / (R应用 + R扩展)2
电流和功率输出都不是燃料电池的唯一特性,因为两者都是由用户选择的外部电阻(负载)决定的。
为了在运行燃料电池中实现可持续的热条件,通常需要工作电流不低于某个最小值锟絀min锟或高于某个最大值锟絀max锟。工作电流(功率输出)的允许值范围和在不同负载下工作的能力是每个燃料电池的重要特性。
燃料电池发电厂的总质量包括两个部分:(i)发电厂适当的锟組PP锟的质量,包括所有辅助装置,但没有反应物及其容器,以及(ii)反应物(燃料和氧气)和相应的容器的质量。最后的质量取决于预期的运行时间 锟 τ锟 ,对于恒定负载(工作电流),它与这个时间成正比 锟組反应 = m反应 × τ锟 。其中锟絤反应锟是操作一小时所需的反应物的质量。因此,总质量是运行时间的线性函数:
[注20]M总量 = MPP + m反应 × τ
通常需要比较不同尺寸或性质的燃料电池的电气特性和其他特性。当使用简化或归一化的参数时,这最容易实现,例如,比功率是指发电厂的质量锟組PP锟(W/kg)或比能量是指发电厂的总质量锟組总锟(Wh/kg)或类似的特定参数,称为相应体积的单位。
从理论上讲,只要提供反应物并去除反应产物和热量,燃料电池就应该无限期地工作。然而,在实践中,从长远来看,燃料电池的效率会下降。这可以从电池电压的逐渐降低(通常以μV/h为单位)中看出。
本文内容来源于:氢燃料电池,责任编辑:胡静,审核人:李峥
版权声明∶转载新能源网站内容,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱∶process@vogel.com.cn,请添加小编微信号(msprocess)详细沟通。
相关推荐
-
Ⅳ型储氢瓶技术优势解析、市场分析
随着行业对储氢要求的不断提升和发展,储氢瓶也必然将实现由I型、II型向III型、IV型的产品迭代。目前I型、II型储氢瓶发展成熟、成本较低,但由于储氢密度较低、质量较大、氢脆问题严重,难以满足车载储氢的要求,通常用于加氢站等固定储氢领域
2024-02-05 氢眼探索
-
盘点2023全年储能氢能技术:国际首套 300 兆瓦压缩空气储能系统、抽水蓄能成套核心控制系统等
2023年4月,我国首个大规模抽水蓄能人工智能数据分析平台——南方电网抽水蓄能人工智能数据分析平台 XS-1000D 投入运行
2024-01-31 中能传媒研究院
-
2023大型绿氢装备订单TOP10企业
中国电解水制氢新增订单量为1035MW,其中碱性电解水制氢订单量达93%。经专业机构调研数据所得,2023碱性水电解槽的订单排行榜出炉。
2024-01-31 21世纪氢能
热点文章
-
国家管网集团氢能管道项目启动;国富氢能齐鲁液氢项目正式量产
2025-11-17
-
在线研讨会预告|流态干扰对超声波流量计测量有何影响?
2025-11-14
-
曾毓群:磷酸铁锂迎五代迭代,多项电池技术实现重大突破
2025-11-14
-
国家电投青海海西州电网侧储能项目开工;南网储能在运抽水蓄能规模突破1100万千瓦
2025-11-18
-
氨裂解转化为氢在安特卫普实现
2025-12-02
-
氨为氢能产业带来发展新机遇
氢能作为一种备受追捧的零污染高效能源,其稀缺性使得人们对其渴求不已。然而,能耗巨大的压缩过程以及极低温度下的液化环节,被视为通往氢能转型之路上的重大障碍。在此背景下,氨成为热门的替代选项,尽管这种物质带有些许气味,但它有望成为能源转型中的奇迹材料。
作者:Dominik Stephan
-
氨为氢能产业带来发展新机遇
-
氨为氢能产业带来发展新机遇
-
氨为氢能产业带来发展新机遇
-
艾默生自动化技术助力绿氢安全高效生产
-
艾默生自动化技术助力绿氢安全高效生产













评论
加载更多